How can a cooling tower spread Legionnaires' Disease?
January 29, 2018 0 Comments

Calculos Basicos para Torres de Enfriamiento
February 28, 2017 0 Comments

Cooling Tower Basic Calculations
February 28, 2017 0 Comments
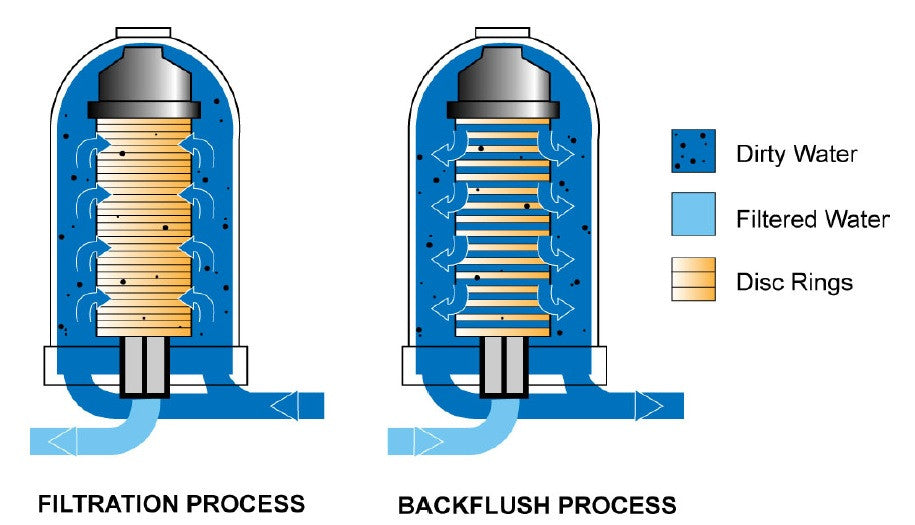
Implementacion del Sistema de Filtracion Lateral para la Torre de Enfriamiento
February 22, 2017 0 Comments

Chlorine Dioxide for Effective Water Treatment
January 16, 2017 0 Comments








